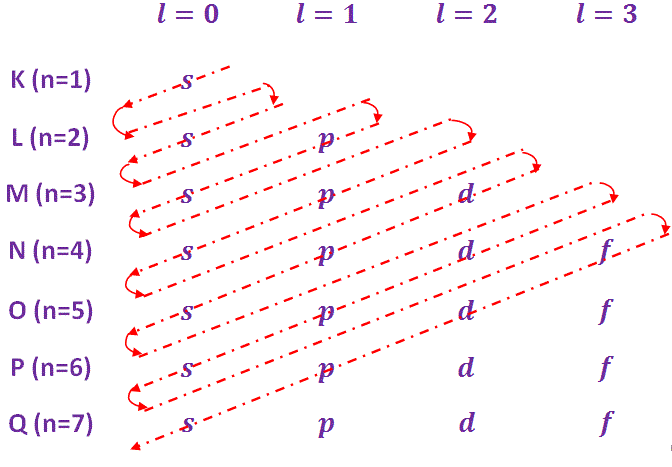原子的电子排布表示电子是如何分布的原子在轨道(壳层)和亚壳层之间。的原子的电子排布它非常重要,因为它有助于预测物质的化学、电和磁性行为。根据原子的电子构型,我们可以预测两种物质是否会发生化学反应,如果发生反应,我们还可以预测反应的类型和强度。
的原子的电子排布,描述电子在原子核周围空间的排列。电子分布在不同的能级上。这些能级被称为壳层或轨道。
基本上,电子在不同的壳层(能级)上的分布是这样的,一个原子的所有电子的整体能量保持在原子稳定的最小值。
不同能级上的电子分布受以下规律支配-
- 在任意主能级(壳层)中,最大电子数为' 2n2’,其中n为整数,表示“主量子数”。对于不同的主能级,n的值和最大电子数见下表-
Sl。不。 能级或轨道(壳层) 主量子数n 最大电子数(2n2) 1 K 1 2×12= 2 2 l 2 2×22= 8 3. 毫克ydF4y2Ba 3. 2×32= 18 4 N 4 2×42= 32
- 每个主壳层(能级)又细分为亚壳层。这些亚能级被称为轨道。这些亚壳层/轨道用s、p、d、f等表示,轨道量子数l = 0,1,2,3,4,.....(n-1)等。任意主壳层的亚壳层数等于“主量子数”n。

- 亚壳层的最大电子容量由2(2l + 1)式决定,亚壳层的容量如表-所示
Sl。不。 亚层 量子数
(左)亚壳层2(2l+1)的电子容量 1 年代 1 2(2 × 0+1) = 2 2 p 2 2(2 × 1+1) = 6 3. d 3. 2(2 × 2+1) = 10 4 f 4 2(2 × 3+1) = 14
- 构造原理
Aufbau是一个德语单词,意思是“建立”。因此,“构造原理”也被称为“构造原理”。根据这一原理,电子按能量递增的顺序占据轨道。各轨道的能量增长顺序和占据顺序如下-
1 s < 2 s < 2 p < 3 < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f < 5 d < 6 p < 7 s < 5 f < 6 d < 7 p
为了简化对能量递增顺序的理解,采用了“马德隆法则”,即
基于以上规则,原子的电子构型一些元素如下表所示
| 元素 | 化学符号 | 原子没有。 | 电子在轨道(壳层)上的分布2n2 | 原子的电子构型 | |||
| K (n = 1) | L (n = 2) | 米(n = 3) | N (N = 4) | ||||
| 氢 | H | 1 | 1 | 0 | 0 | 0 | 11 |
| 氦 | 他 | 2 | 2 | 0 | 0 | 0 | 12 |
| 锂 | 李 | 3. | 2 | 1 | 0 | 0 | 122 s1 |
| 铍 | 是 | 4 | 2 | 2 | 0 | 0 | 122 s2 |
| 硼 | B | 5 | 2 | 3. | 0 | 0 | 122 s22 p1 |
| 碳 | C | 6 | 2 | 4 | 0 | 0 | 122 s22 p2 |
| 氮 | N | 7 | 2 | 5 | 0 | 0 | 122 s22 p3. |
| 氧气 | O | 8 | 2 | 6 | 0 | 0 | 122 s22 p4 |
| 氟 | F | 9 | 2 | 7 | 0 | 0 | 122 s22 p5 |
| 霓虹灯 | N | 10 | 2 | 8 | 0 | 0 | 122 s22 p6 |
| 钠 | Na | 11 | 2 | 8 | 1 | 0 | 122 s22 p63 s1 |
| 镁 | 毫克 | 12 | 2 | 8 | 2 | 0 | 122 s22 p63 s2 |
| 铝 | 艾尔 | 13 | 2 | 8 | 3. | 0 | 122 s22 p63 s23 p1 |
| 硅 | 如果 | 14 | 2 | 8 | 4 | 0 | 122 s22 p63 s23 p2 |
| 磷 | P | 15 | 2 | 8 | 5 | 0 | 122 s22 p63 s23 p3. |
| 硫 | 年代 | 16 | 2 | 8 | 6 | 0 | 122 s22 p63 s23 p4 |
| 氯 | Cl | 17 | 2 | 8 | 7 | 0 | 122 s22 p63 s23 p5 |
| 氩 | 基于“增大化现实”技术 | 18 | 2 | 8 | 8 | 0 | 122 s22 p63 s23 p6 |
| 钾 | K | 19 | 2 | 8 | 8 | 1 | 122 s22 p63 s23 p64 s1 或 [阿拉伯文]4 s1 |
| 钙 | Ca | 20. | 2 | 8 | 8 | 2 | 122 s22 p63 s23 p64 s2 或 [阿拉伯文]4 s2 |
| 钪 | Sc | 21 | 2 | 8 | 8 | 2 | 122 s22 p63 s23 p63 d14 s2 或 [阿拉伯文]3 d14 s2 |
其中,[Ar] = 122 s22 p63 s23 p6表示氩的电子构型,它完全充满了3壳层。它是用来简化高原子序数元素的电子构型。